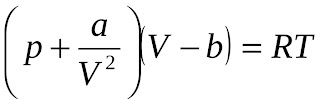Рівняння стану реального
газу
 |
| Ван-дер-Ваальс та його газ |
Закони ідеальних газів,
виведені на основі МКТ, добре описують реальні гази при малих тисках і не
занадто низьких температурах. При підвищенні
тиску чи зниженні температури поведінка реальних газів кількісно та
якісно відрізняється від поведінки газів ідеальних.
Вирішення даної проблеми
запропонував у 1873 році голландський фізик Ван-дер-Ваальс (1837-1923), який
ввів рівняння стану, яке назване його іменем.
Газ Ван-дер-Ваальса – це
така модель реального газу, в якій молекули розглядаються як тверді кульки
певного об’єму (діаметром d), між якими діють
сили взаємного притягання. Наявність власного розміру кульок зумовлює те, що в
даній моделі враховано і сили відштовхування між молекулами реального газу.
[p + (m/μ)2∙a/V2][V
- (m/μ)∙b] = RT
Останнє рівняння носить
назву рівняння Ван-дер-Ваальса, яке для одного моля газу набуває вигляду:
Рівняння стану реального
газу відрізняється від рівняння Клапейрона-Менделєєва введенням двох поправок.
1. Врахування розмірів молекул та сил відштовхування між ними.
b
=
4V0∙N ,
[b] = м3/моль
Поправка b – поправка Ван-дер-Ваальса на власний об’єм молекул
(чисельно дорівнює чотирьом об’ємам всіх молекул в даному об’ємі газу).
2. Врахування сил притягання між молекулами.
Вводиться поправка на
додатковий внутрішній тиск, який зумовлений притяганням молекул:
Δр = а/V2, [a]
= (Па∙м6)/моль2 =
(Н∙м4)/моль2,
де а – коефіцієнт Ван-дер-Ваальса,
який залежить від хімічної природи газу.
На практиці параметри а
та b визначають для кожного газу експериментально.
1. Вода (Н2О) а = 0,5464 (Н∙м4)/моль2; b =0,305∙10-4 м3/моль.
2. Кисень (О2) а = 0,1370 (Н∙м4)/моль2; b = 0,318∙10-4 м3/моль.
3. Азот (N2) a = 0,1390 (Н∙м4)/моль2; b = 0,391∙10-4 м3/моль.
4. Водень (Н2) а = 0,0244 (Н∙м4)/моль2; b = 0,266∙10-4 м3/моль.
Найбільш змістовні
результати можна отримати аналізуючи теоретичні ізотерми реального газу.
 |
|
Ізотерми
реального газу.
Область I – рідина, область II – двофазна система «рідина
+ насичена пара», область III – газоподібна речовина. K – критична
точка. |
Один із багатьох
висновків вказує на те, що газ можна перетворити в рідину лише при температурі,
нижчій за певне її значення – значення критичної температури. При температурах, вищій за критичну, збільшенням тиску не можна
перетворити газ у рідину.
Критичні параметри стану
Ткр, pкр, Vкр
можна виразити через величини а та b газу:
Ткр = 8а/(27Rb); pкр = a/(27b2); Vкр = 3b.
Критичні температури
водяної пари, азоту й кисню відповідно рівні:
T(H2O) =
646K, T(N2) = 128K, T(O2) = 155K.
Виявляється, що
критичні температури азоту й кисню
занадто низькі, щоб ці гази, охолоджуючись вночі, могли сконденсуватися у
вигляді роси.
Теорія Ван-дер-Ваальса
добре описує стан та поведінку реальних газів, що підтверджується
експериментальними дослідженнями, проте вона не застосовна для дуже стиснутих
газів.
Внітрішня енергія
реального газу.
У випадку реального газу
внутрішня енергія є сумою кінетичної енергії хаотичного руху молекул і
потенціальної енергії взаємодії між ними:
U = K +П.
dП = рdV = (a/V2)dV; П = - a/V
+ const
Якщо значення об’єму прямує до безмежності, то
константа інтегрування прямує до нуля і для внутрішньої енергії одного моля
реального газу маємо
U = cμv∙T –
a/V.
Отже внутрішня енергія
реального газу U залежить не лише від температури, а й від об’єму.
(Величина cμv для всіх реальних газів, крім водню, за температур до 1500°С така сама, як
для ідеального газу).
Цікавим виглядає той
факт, що під час ізотермічного розширення реального газу його внутрішня енергія
збільшується.
 |
| Ізотерми Ендрюса та їх експериментальне отримання. |
Доцільно прочитати:
- 1. Ізопроцеси.
- 2. Молекулярно-кінетична теорія.
- 3. Насичена пара.
- 4. Вологість повітря.
- 5. Начала термодинаміки.
- 6. Модель ідеального газу.