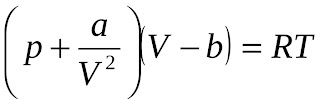Рівняння стану реального
газу
 |
| Ван-дер-Ваальс та його газ |
Закони ідеальних газів,
виведені на основі МКТ, добре описують реальні гази при малих тисках і не
занадто низьких температурах. При підвищенні
тиску чи зниженні температури поведінка реальних газів кількісно та
якісно відрізняється від поведінки газів ідеальних.
Вирішення даної проблеми
запропонував у 1873 році голландський фізик Ван-дер-Ваальс (1837-1923), який
ввів рівняння стану, яке назване його іменем.
Газ Ван-дер-Ваальса – це
така модель реального газу, в якій молекули розглядаються як тверді кульки
певного об’єму (діаметром d), між якими діють
сили взаємного притягання. Наявність власного розміру кульок зумовлює те, що в
даній моделі враховано і сили відштовхування між молекулами реального газу.
[p + (m/μ)2∙a/V2][V
- (m/μ)∙b] = RT
Останнє рівняння носить
назву рівняння Ван-дер-Ваальса, яке для одного моля газу набуває вигляду: